Staphylococcus intermedius - коагулазоположительный стафилококк, преобладающий представитель микрофлоры кожи и слизистых оболочек собак и самый распространенный возбудитель стафилококковых инфекций в ветеринарии мелких животных за последние 35 лет.
Хотя микробиологические исследования показали вариабельность биохимических свойств разных штаммов S. intermedius, выделенных у животных, обычное фенотипическое тестирование дает приемлемый уровень диагностической точности для клинических целей. Тем не менее три последние разработки изменили наше понимание S. intermedius, и ветеринарные микробиологи столкнулись с проблемой правильности идентификации патогенных стафилококков мелких животных. Во-первых, растущее распространение устойчивых к метициллину штаммов Staphylococcus aureus в ветеринарной практике мелких животных и в медицине требует точной идентификации видов. Во-вторых, применение молекулярных методов для анализа выделенных штаммов стафилококков привело к пересмотру таксономии, и выделенные от собак штаммы, ранее относившиеся к S. intermedius, были отнесены к S. pseudintermedius. В-третьих, быстрое появление штаммов Staphylococcus pseudintermedius, устойчивых к метициллину и нескольким антибиотикам (MRSP), представляет большую проблему в ветеринарной практике всего мира, в том числе в Великобритании. В данной статье обсуждаются основы недавних изменений таксономии рода Staphylococcus, рассматриваются его ключевые особенности и значение для лабораторной диагностики и ветеринарии мелких домашних животных.
СТАФИЛОКОККИ. ВВЕДЕНИЕ
Большинство ветеринарных врачей, специализирующихся на мелких животных, ежедневно встречаются со стафилококковыми инфекциями кожи и ран [34]. Большинство стафилококков - факультативные анаэробы, каталазоотрицательные, неподвижные грамполо-жительные микроорганизмы с клеточными стенками, содержащими тейхоевую кислоту и пептидогликаны, а также 30-40 % гуанина и цитозина, видимых под микроскопом в форме глыбок [54]. Основной патогенный вид образует коагулазу - фермент, коагулирующий плазму за счет превращения фибриногена в фибрин. Роль коагулазоотрицательных стафилококков как патогенных микроорганизмов относительно мала; это преимущественно возбудители больничных инфекций у ослабленных животных.
Описано 54 видов и 24 подвида, из которых наибольшее значение в ветеринарной медицине имеют Staphylococcus aureus и Staphylococcus intermedius. Однако после недавних таксономических изменений, описанных ниже, все штаммы, выделенные от собак (и, возможно, от кошек), ранее относившиеся к S. intermedius, в настоящее время следует относить к Staphylococcus pseudintermedius. В настоящем обзоре термин “S. pseudintermedius" относится к штаммам, в более старых источниках классифицируемых как S. intermedius (это относится к штаммам, выделенным от собак и кошек).
ЭКОЛОГИЯ
Стафилококки, коагулазоположительные (Ко+) и ко-агулазоотрицательные (Ко-), являются нормальными обитателями кожи и слизистых оболочек животных и человека. Отмечена тенденция к предпочтительному заселению кожи и слизистых оболочек млекопитающих и птиц определенными видами стафилококков. Стафилококки, попавшие в окружающую среду с кожи и шерсти, способны сохранять жизнеспособность в течение нескольких месяцев [53, 79]. У людей более 80 % больничных инфекций S. aureus вызываются эндогенными штаммами, обитающими в носовой полости пациента [78]. Сходным образом Pinchbeck and others [58] показали, что более 94 % штаммов S. pseudinterme-dius, выделенных из пораженных участков кожи собак с пиодермой, были генетически идентичны штаммам, обитающим на нормальных покровах этой же собаки.
У собак преобладающим видом является S. pseudin-termedius, который выделяется с кожи и слизистых оболочек здоровых собак в 20-90 % случаев [2, 14, 17, 28, 32]. Частота выделения отдельных Ко+ стафилококков с кожи и шерсти здоровых кошек составляет приблизительно 10 % для S. aureus и 45 % для S. pse-udintermedius [1, 12, 41].
ПОСЛЕДНИЙ ПЕРЕСМОТР ТАКСОНОМИЧЕСКОЙ КЛАССИФИКАЦИИ “S. INTERMEDIUM
В обзоре таксономической классификации от 1992 г. Noble ссылается на работу 1962 г. под названием “An introduction to chaos: or the classification of micrococci and staphylococci" (Введение в хаос: классификация микрококков и стафилококков); на момент написания этой работы было известно всего три вида стафилококков, а именно S. aureus, S. epidermidis и Staphylococcus saprop-hyticus. Появление молекулярно-биологических методов стало основой для обширного пересмотра классификации стафилококков. В настоящее время род включает 45 видов и 24 подвида, которые можно отнести к 11 кластерам по результатам секвенирования гена 16S РНК и 4 кластерам по результатам секвенирования gap-гена [24].
С точки зрения ветеринарной дерматологии можно констатировать, что хаос никуда не делся, а лишь немного изменил свою форму ввиду фенотипической внутри- и межвидовой вариабельности среди микроорганизмов, родственных S. intermedius. Staphylococcus inter-medius был впервые описан Hajek [30], который выделил стафилококков, по биохимическим свойствам находящихся «между» S. aureus и S. epidermidis (промежуточные штаммы - intermedius), от голубей, собак, норок и лошадей. Вскоре стало очевидно, что большинство штаммов Ко+ стафилококков, выделенных от собак, фактически принадлежат к S. intermedius, а не S. aureus, как в предыдущей классификации. Однако позднее было показано, что значительная фенотипическая вариабельность среди S. intermedius, отмеченная Hajek [30] и через некоторое время - Devriese и van de Kerckove [18], отражает значительную генотипическую вариабельность [4, 10, 49]. Staphylococcus pse-udintermedius был впервые описан в 2005 г. после молекулярного анализа штаммов, выделенных от кошек, собак, лошадей и попугаев. Фенотипические свойства были сходны с таковыми у S. intermedius и Staphylococcus delphini, видов, впервые выделенных у дельфинов в 1988 г. [19, 77]. В 2007 г. две научные группы опубликовали результаты подробного филогенетического анализа коллекций штаммов “S. intermedius" из Японии [65] и Европы [4], которые были очень сходны; авторы показали, что все их штаммы от собак, кошек и людей относились к виду S. pseudintermedius. Большинство штаммов, выделенных от диких голубей, относились к S. intermedius, а большинство штаммов от лошадей и домашних голубей принадлежали к виду S. delphini. В то время как подробное биохимическое исследование позволяет дифференцировать S. intermedius от S. pseudintermedius и S. delphini, единственным достоверным способом дифференциации двух последних видов является исследование молекулярными методами, например секвенирование гена термонуклеазы (nuc), или белка теплового шока (hsp60) [65], или рестрикция эндонуклеазой MboI фрагмента гена pta [5, 67]. Результаты этих молекулярных исследований подтверждают правильность введения термина “группа S. intermedius", которая включает по меньшей мере три близкородственных вида: S. intermedias, S. delphini и S. pseudintermedius [4, 24, 67, 70].
Все эти наблюдения указывают, что штаммы с традиционными фенотипическими характеристиками “S. intermedius" должны идентифицироваться как S. pseudintermedius, если они выделены от собак. Штаммы с такими свойствами, выделенные от других видов, лучше всего идентифицировать как «бактерии группы S. intermedius», если нет результатов оценки молекулярно-биологическими методами [33]. Хотя молекулярнобиологические методы позволили прояснить таксономию бактерий группы S. intermedius, фенотипическая классификация в диагностических лабораториях все еще пребывает в состоянии хаоса из-за различий в экспрессии биохимических свойств как в пределах одного вида, так и между видами, относящимися к группе S. intermedius. Например, сообщается, что S. pseudintermedius в культуре образует ацетоин (реакция Фогеса-Проскауэра) при анализе с помощью набора API STAPH (Био Мерье) [19]. В противоположность этому, по данным Sasaki and others [65], 28 из 83 штаммов S. pseudintermedius, идентифицированные молекулярно-биологическими методами, не образуют ацетоин при исследовании стандартными методами, и исследование с помощью набора API STAPH не показывает образование ацетоина. Кроме того, сообщается, что данная культура не образует фактор агглютинации при исследовании с плазмой кролика, в то время как, по данным Cox and others [13], 55 из 105 выделенных от собак штаммов “S. intermedius" (и, вероятно, S. pseudinterme-dius) экспрессировали фактор агглютинации, что согласуется с общепринятым представлением, которого придерживаются многие ветеринарные микробиологи. Описанные ранее данные, касающиеся S. intermedius, нуждаются в переоценке, так как некоторые штаммы, ранее классифицировавшиеся как S. intermedius, могут с высокой вероятностью принадлежать к S. pseudin-termedius или S. delphini [20].
УСТОЙЧИВОСТЬ К АНТИБИОТИКАМ
В прошлом большинство инфекций собак, вызываемых 5. pseudintermedius, удавалось успешно лечить антибиотиками, назначавшимися эмпирически или по результатам оценки антибиотикочувствительности, поскольку полирезистентность, т. е. устойчивость к по меньшей мере трем классам антимикробных препаратов, в дополнение к р-лактамам [11], в то время встречалась крайне редко, по крайней мере - в Европе [27,29, 43, 56, 60]. В Великобритании исследование более 1200 штаммов стафилококков, выделенных в клинических условиях за период с 1987 по 1995 гг, не показало устойчивости к цефалексину, амоксиклаву, окса-циллину/метициллину и энрофлоксацину [43]. Фактически резистентность к любому из цефалоспоринов первого поколения не была достоверно подтверждена. В Европе резистентность к цефалексину была впервые описана у S. pseudintermedius, выделенного от собак в специализированной дерматологической ветеринарной клинике в Германии в 2005 г.; одновременно была обнаружена резистентность к метициллину и нескольким другим антибактериальным препаратам [45].
ШТАММЫ S. PSEUDINTERMEDIUS, УСТОЙЧИВЫЕ К МЕТИЦИЛЛИНУ (MRSP)
Метициллин, полусинтетический антибиотик из группы пенициллинов, был введен в 1959 г. для борьбы со стафилококками, образующими р-лактамазу и устойчивыми к пенициллину. Вскоре после этого были выделены штаммы S. aureus, устойчивые к метициллину (MRSA), преимущественно в условиях стационара. В основе устойчивости к метициллину лежит экспрессия гена mecA, кодирующего модифицированный белок клеточной стенки, связывающий пенициллин (PBP2a), низкое сродство которого к р-лактамным антибиотикам делает пенициллины и цефалоспорины неэффективными. Ген mecA располагается в стафилококковой хромосомной кассете mec (SCCmec), крупном мобильном генетическом элементе, при этом дополнительные генетические детерминанты часто придают микроорганизму дополнительную устойчивость к другим антибиотикам, использующимся в клинической практике.
Встраивание элемента SCCmec в геном штаммов S. pseudintermedius привело к резкому росту распространенности устойчивых к метициллину штаммов по Европе, главным образом в период с 2005 по 2006 г [45, 57, 62, 66]. В отчете об исследовании S. intermedius в Северной Америке сообщается, что в период с 2003 по 2004 г. устойчивостью к метициллину обладали 57 из 336 выделенных штаммов (17 %) [50], в то время как за период с 1995 по 1998 г. лишь один штамм стафилококков из 25 обладал устойчивостью к метициллину [26]. В Европе устойчивостью к метициллину обладало 23 % штаммов S. pseudintermedius, выделенных в дерматологической клинике на севере Германии за 2006 г [45]. Частота выделения устойчивых к метициллину стафилококков (n = 61, 7,4 % MRSP) была более чем в 4 раза выше, чем MRSA (n = 15, 18,75 % выделенных штаммов S. aureus), по данным обзора, 901 Ко+ штамма стафилококков, выделенных от собак в Германии за 2007 г [62]. По результатам обзора 590 образцов от собак, представленных в диагностическую ветеринарную лабораторию в Италии за двухмесячный период в 2008 г., на MRSP приходилось 10 из 48 выделенных штаммов из группы 5. intermedius (21 %); все эти штаммы, устойчивые к метициллину, были также устойчивы к фторхинолонам, гентамицину, линкозамидам, тетрациклинам и потенцированы [15], что отражает приобретение дополнительных генов, обусловливающих устойчивость.
По-видимому, данные о распространенности в Великобритании не публиковались в реферируемых журналах, хотя коммерческая лаборатория в Девоне, Великобритания, недавно сообщила, что на MRSP приходится 14 % из 125 Ко+ штаммов, выделенных за 12-месячный период вплоть до июля 2008 г. [68]. Эти штаммы были устойчивы к большему числу антибиотиков, чем штаммы MRSA, выделенные за этот же период.
МЕТОДЫ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ ДЛЯ ИССЛЕДОВАНИЯ ЭПИЗООТОЛОГИИ MRSP
Для эффективного и точного типирования клонов S. pseudintermedius был разработан ряд молекулярных методов. Эти методы показали выраженное генетическое разнообразие среди штаммов S. pseudintermedius, чувствительных к метициллину [63]. Метод муль-тилокусного секвенирования-типирования позволяет типировать выделенные штаммы путем секвенирова-ния внутренних фрагментов многочисленных конститутивных генов (пять в случае S. pseudintermedius в настоящее время). При исследовании каждого конституционного гена разные последовательности, имеющиеся у бактерий определенных видов, относятся к определенным аллелям, и аллели в каждом из пяти локусов каждого штамма определяют аллельный профиль типа последовательности (ТП); профили легко сравнить с хранящимися в интернет-базах данных. Типирование белка А S. aureus включает амплификацию, секвени-рование и анализ различных областей Х гена белка А. Метод импульсного гель-электрофореза заключается в гидролизе геномной ДНК эндонуклеазой SmaI и последующем электрофоретическом разделении фрагментов ДНК в агарозном геле. Вставка элемента SCCmec в хромосому чувствительных видов является причиной возникновения линий стафилококков, устойчивых к метициллину При типировании SCCmec определяются типы генов рекомбиназы (ссг) вместе с классом гена :таес и связанные регуляторные последовательности. В отличие от наблюдаемой генетической вариабельности MSSP исследование штаммов MRSP показало, что у собак и кошек в Европе преобладает один клон, в частности с типом последовательности ST71 (MLST)-J(PGFE)-t02(spa)-II-III(SCCmec). Этот клон был выделен в Германии, Швейцарии, Нидерландах, Дании, Швеции и Италии и, спорадически, в Северной Америке и Гонконге [4, 7, 37, 57, 63]. В Северной Америке также обнаружен один преобладающий клон, в частности ST68-C-t06-V [57, 63]. Наблюдающееся в настоящее время отсутствие штаммов ST71 5. pseudinterme-dius, чувствительных к метициллину, не подтверждает одновременное и быстрое приобретение SCCmec широко распространенной и успешно развивающейся линией 5. pseudintermedius, а скорее свидетельствует о быстром распространении этого конкретного клона. Эти молекулярные эпизоотологические данные позволяют предположить, что при выделении микроорганизмов и обнаружении инфекции у животных необходимы тщательные гигиенические меры, чтобы ограничить дальнейшее распространение.
ЗООАНТРОПОНОЗНЫЙ ПОТЕНЦИАЛ.
Staphylococcus pseudintermedius редко обнаруживается на коже человека, хотя частота его передачи среди людей, регулярно соприкасающихся с собаками, растет [25, 29, 32]. Из 3397 штаммов, выделенных от пациентов больниц общего профиля, 3357 относились к S. aureus, и только два принадлежали к S. pseudinter-medius [48], хотя описаны случаи ошибочной идентификации S. pseudintermedius как S. aureus в медицинских лабораториях, для которых последний вид был привычнее [39, 59, 67, 72, 76]. Исследование на 56 здоровых добровольцах не показало наличия S. pseudinter-medius на слизистой оболочке носа, хотя у 89 % этот микроорганизм был обнаружен в слюне и зубном налете [55]. В исследовании персонала ветеринарного колледжа частота выделения микроорганизма со слизистой оболочки ротоглотки составила менее 1,5 % [44, 71], однако результаты более поздних исследований владельцев собак показывают большие цифры. Исследование наружных носовых ходов 16 владельцев собак с атопическим дерматитом и 13 сотрудников ветеринарной клиники, постоянно контактирующих с собаками, на стафилококков выявило одного постоянного и четырех временных носителей Staphylococcus “interme-dius" [32]; штаммы, выделенные от людей, обычно соответствовали штаммам, выделенным от собак, с которыми они контактировали [25]. В исследовании 242 владельцев собак и кошек в Онтарио S. pseudintermedius был выделен от девяти людей, а неотличимые от него штаммы выделены от собак в четырех из девяти случаев носительства [31]. Guardabassi and others [29] показали, что носительство S. pseudintermedius на слизистой оболочке носовой полости среди владельцев собак с глубокой пиодермой встречалось чаще (7 из 13), чем у людей без ежедневного контакта с собаками (1 из 13), и что у 6 из 13 владельцев обнаружены штаммы, идентичные выделенным от их собак по результатам электрофореза.
Появление штаммов MRSP привело к выяснению но-сительства у людей, контактирующх с собаками, а также спорадических случаев инфекции у людей [8, 23, 39, 69]. MRSP были выделены от пяти собак и одной кошки с инфицированными хирургическими ранами в лаборатории в Нидерландах [74]. В ходе дальнейших исследований из носовой полости ветеринарного врача и 3 из 6 ассистентов, из 4 из 22 образцов из среды, а также из носовой полости здоровой собаки, принадлежащей сотруднику, регулярно присутствовавшему в клинике, были выделены MRSP с такой же картиной устойчивости. MRSP и MRSA были выделены из 3 и 8 из 34 образцов соответственно, взятых у ветеринарных врачей из университетской ветеринарной клиники в Японии, при этом все 36 образцов от сотрудников неклинических лабораторий оказались отрицательными [36]. Обзор по результатам исследования 171 сотрудника ветеринарных дерматологических клиник и их животных в Северной Америке показал наличие MRSP у девяти человек и MRSA у шести [51]. Соответствующие штаммы MRSP были выделены от животных, содержащихся в доме, где жили три человека-носите-ля. По данным другого исследования в Северной Америке, носительство MRSP на слизистой оболочке носовой полости было обнаружено у 2 из 15 владельцев собак, инфицированных MRSP с тем же типом SCCmec и картиной восприимчивости к антибиотикам; при повторном отборе проб через два месяца после лечения эти штаммы отсутствовали, что позволяет предположить временное носительство MRSP людьми [21]. В сходном исследовании, проведенном в Нидерландах, результат анализа проб со слизистой оболочки носа людей оказался положительным в 2 из 45 случаев, в то время как MRSP были выделены из примерно трети образцов от собак и кошек, находившихся в контакте, и 44 % образцов из окружающей среды [75]. Эти наблюдения очевидно свидетельствуют о возможности передачи стафилококков от людей к собакам и наоборот. Хотя контакт человека с 5. pseudintermedíus от собаки, скорее всего, приведет лишь к временному неочевидному носительству, в редких случаях возможно развитие инфекции, сложно поддающейся лечению в случае MRSP [69]. Кроме того, собачьи штаммы MRSP должны рассматриваться как потенциальный источник переноса SCCmec и, возможно, других мобильных детерминант устойчивости стафилококков, обитающих на коже и слизистых оболочках человека, к антибиотикам [29].
ЗНАЧЕНИЕ ДЛЯ ЛАБОРАТОРНОЙ ИДЕНТИФИКАЦИИ
Видовая дифференциация патогенных стафилококков сложнее, чем предполагают стандартные микробиологические тесты [59, 73]. Перед появлением MRSA как патогена собак видовая идентификация Ко+ стафилококков, выделенных от собак, имела минимальное клиническое значение. Однако в настоящее время точная видовая идентификация и дифференциация MRSA и MRSP необходима в связи со значительным различием в зооантропонозном потенциале этих двух видов, и пограничные значения при исследовании восприимчивости in vitro могут различаться. Начальная идентификация стафилококков с точностью до рода возможна по морфологии колоний (гладкие, выпуклые, слегка блестящие, от белого до желтого цвета, диаметром от 1 до 2 мм после 24-часовой инкубации на кровяном или другом питательном агаре при 37 °C [6]); результатам микроскопии (грамположительные кокки) и образованию каталазы (этот признак позволяет дифференцировать их от стрептококков и энтерококков; обзор Freney and others [22]).
Образование ДНКазы и коагулазы - важные показатели патогенности стафилококков. Экспрессию коагулазы тремя штаммами Ко+, часто выделяемыми от мелких животных (S. pseudintermedius, S. aureus и S. schleiferi ssp. coagulans), можно обнаружить путем пробирочной реакции (свободная коагулаза) или реакции на стекле (связанная коагулаза или фактор агглютинации) [6]. Хотя пробирочный метод с кроличьей плазмой считается «золотым стандартом», реакция на стекле быстрее, легче и дешевле. Однако даже этот базовый метод не дает однородных результатов. Исследование стандартными методами показывает, что только 11-89 % штаммов S. intermedius дает положительную реакцию в противоположность 100 % в пробирочном методе [22, 40], и некоторые Ко+ штаммы могут ошибочно классифицироваться как Ко- из-за недостаточной чувствительности метода [12, 13].
Дифференциация между членами группы S. inter-medius в настоящее время требует молекулярно-биологических методов (например, мультилокусное сек-венирование или рестрикция MboI фрагмента гена pta) [5, 65, 67], однако дифференциация MRSA и MRSP возможна на основании точно подобранного ряда фенотипических параметров. Биохимические свойства, особенно способность к сбраживанию сахаров, помогают дифференцировать Ко+ штаммы. Биохимические свойства S. aureus, “S. intermedius” и S. schleiferi spp. coagulans кратко описаны в стандартных учебниках микробиологии [6, 40, 46], а S. pseudintermedius - в более новых публикациях [19, 65]; методы, используемые в лаборатории авторов, представлены в таблице.
Однако хорошо известно, что ни один из этих методов не является точным на 100 %, поэтому желательно использовать несколько методов параллельно [47, 61]. 21 % из 133 штаммов MRSA, выделенных авторами от животных, не обладали классической золотистой пигментацией (см. рисунок). Реакция Фоге-са-Проскауэра - экономически эффективный и не требующий больших затрат времени метод, хотя при его использовании отмечена некоторая вариабельность [65]; этот метод должен давать положительную реакцию с S. aureus и отрицательную с группой S. intermedius [6]. Основанием для подозрений на MRSP является типичная картина чувствительности к антибиотикам. В Великобритании эти штаммы обычно устойчивы к антимикробным препаратам, часто использующимся для лечения пиодермы у собак (потенцированные сульфонамиды, линкомицин, клинда-мицин, ко-амоксиклав, цефалексин, энрофлоксацин, марбофлоксацин), в то время как штаммы MRSA, выделенные от мелких животных, чаще всего чувствительны к потенцированным сульфонамидам, тетра-циклинам и иногда - клиндамицину. Обнаружение гена mecA методом полимеразной цепной реакции или его продукта (PBP2a) методом латексной агглютинации часто практикуется в медицинских лабораториях, но не в ветеринарных. Методы молекулярного типирования, описанные выше в разделе о таксономии, пока не получили широкого распространения в коммерческих ветеринарных микробиологических лабораториях, хотя по описанным ниже причинам они необходимы для точной дифференциации MRSP и MRSA.
Таблица. 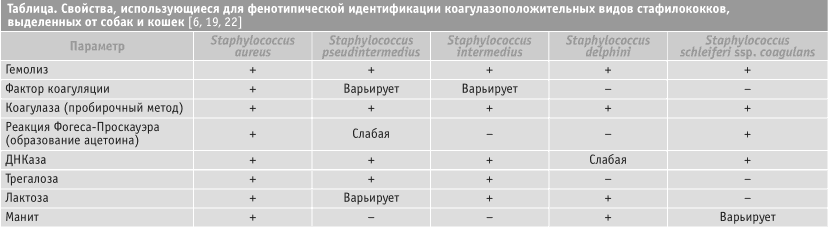
ЛЕЧЕНИЕ ИНФЕКЦИЙ, ВЫЗВАННЫХ MRSP
Хотя устойчивость стафилококков к метициллину не всегда связана с полирезистентностью, большинство штаммов MRSP, описанных в литературе, устойчивы к большинству препаратов, использующихся в ветеринарии. Клон MRSP, преобладающий в Европе, обычно устойчив к р-лактамным антибиотикам, ами-ногликозидам, макролидам, линкозамидам, тетрацик-линам, хлорамфениколу, триметоприму и фторхино-лонам и чувствителен только к амикацину, фусидовой кислоте, рифампицину, ванкомицину, тейкопланину и линезолиду, однако ни один из этих последних препаратов не лицензирован для системного лечения мелких домашних животных [16, 57]. В 2009 г. консультативная группа Всемирной организации здравоохранения по объединенному надзору за резистентностью к антибиотикам (AGISAR) выпустила стандартный документ, призванный помочь сформулировать и определить приоритеты оценки риска и стратегий управления рисками, связанными с устойчивостью к антибиотикам. Согласно их классификации антимикробные препараты делятся на критически важные, очень важные и важные на основании их роли как единственного лечебного средства или одной из немногих альтернатив для лечения серьезных заболеваний у человека, или заболеваний, вызванных микроорганизмами, передающимися из других источников (не от человека), или микроорганизмами, способными приобретать детерминанты устойчивости из других источников [81].
Амикацин и рифампицин входят в список препаратов критической важности для лечения микобак-териальных инфекций у человека, в то время как ван-комицин, тейкопланин и линезолид относятся к препаратам, имеющим критическую важность для лечения инфекций, вызванных полирезистентными MRSA и энтерококками. Фусидовая кислота - единственный антибиотик, который может оказаться эффективным против европейских штаммов MRSP, выделенных от собак, который не входит в категорию критически важных; она входит в список очень важных препаратов для лечения MRSA.
Иногда поверхностные кожные инфекции и некоторые раневые инфекции хорошо поддаются лечению местными средствами в сочетании с коррекцией первопричины либо после удаления инородного материала, например швов или имплантатов. Loeffler and others [45] описали разрешение поверхностной пио-дермы, вызванной MRSP, у пяти из семи собак после местного применения препаратов фусидовой кислоты и хлоргексидина, а также шампуня, содержащего этиллактат.
Для лечения глубокой пиодермы или других серьезных инфекций может потребоваться назначение системных антибактериальных препаратов, не соответствующее утвержденным показаниям, хотя данных об оптимальной дозировке и частоте применения та-
ких препаратов часто недостаточно. Амикацин не всасывается из пищеварительного тракта и должен вводиться в инъекционной форме. Рифампицин можно давать внутрь, однако при этом существует риск развития устойчивости, особенно при применении в форме монотерапии [38], а риск гепатотоксичности требует регулярного контрольного биохимического исследования крови. Описаны отдельные штаммы MRSP с устойчивостью к рифампицину [57]. В то время как 54 из 57 штаммов MRSP из Северной Америки были чувствительными [50], среди 25 европейских штаммов чувствительностью обладали всего 30-40 % [15, 16]. Такое географическое различие подчеркивает важность выбора препарата для лечения MRSP по результатам определения чувствительности отдельных штаммов in vitro.
Случаи устойчивости MRSP к ванкомицину, тей-копланину и линезолиду до настоящего времени неизвестны [57, 62], хотя Perreten and others высказали сомнения в целесообразности применения этих антибиотиков для лечения животных. Ввиду статуса этих препаратов в медицине в качестве резервных для лечения бактериемии, вызванной MRSA, и активного изучения использования антибиотиков в ветеринарии Европейским агентством по лекарственным средствам (ЕМЕА) авторы придерживаются мнения, что применение ванкомицина, тейкопланина и линезолида в ветеринарии не оправдано.
В медицинской литературе в качестве дополнения к терапии инфекции MRSA рекомендуют местную обработку для уничтожения микроорганизма, хотя данные о ее эффективности противоречивы. Местные формы антибиотиков, таких как мупироцин, фу-сидовая кислота или хлоргексидин, наносятся на поверхности обитания микроорганизмов для уничтожения MRSA, чтобы их место заняли менее устойчивые стафилококки. Результаты исследований с применением такой обработки слизистой оболочки носовой полости / анальной области у собак с MRSP пока не описаны, хотя показано, что местное нанесение фу-сидовой кислоты на слизистую оболочку носа и анус уменьшает носительство S. pseudintermedius на коже здоровых собак породы бигль [64]. По опубликованным данным, системная антибиотикотерапия с цефподоксимом не приводит к удалению чувствительных Ко+ стафилококков из зон носительства [35]; кроме того, цефалоспорины третьего поколения являются критически важными антибиотиками в медицине.
ПРОФИЛАКТИКА И КОНТРОЛЬ СТАФИЛОКОККОВЫХ ИНФЕКЦИЙ, ВЫЗВАННЫХ ПОЛИРЕЗИСТЕНТНЫМИ ШТАММАМИ
Распространение 5. pseudintermedius с кожи собак и кошек ответственно за частое обнаружение этого микроорганизма в среде ветеринарных клиник [74]. При обнаружении или подозрении на инфекцию или
носительство MRSP у животных необходимо принять тщательные меры предосторожности во избежание больничных инфекций и дальнейшего распространения этой полирезистентной бактерии [42]. Эти меры должны включать личную гигиену (мытье рук, использование масок, халатов и перчаток при хирургических вмешательствах) и гигиену окружающей среды (регулярную очистку и дезинфекцию всех поверхностей в клинике для уничтожения MRSA [52] и других контагиозных микроорганизмов [9] согласно рекомендациям).
До настоящего времени среди полирезистентных стафилококков не было обнаружено штаммов, устойчивых к моющим средствам и дезинфектантам; показано, что распространенные в ветеринарной практике дезинфицирующие средства обладают ингибирующим действием MRSP даже в низких концентрациях [3].
ВЫВОДЫ
Выделенные от собак штаммы, ранее классифицировавшиеся как S. intermedins, в настоящее время следует относить к S. psendintermedins. Термин “группа S. intermedins” следует использовать для обозначения штаммов, выделенных от других хозяев, при отсутствии результатов молекулярного исследования. Быстрое появление и широкое распространение MRSP в Европе и Северной Америке, как прогнозировал Waller [80], представляет значительную проблему как для ветеринарии, так и для медицины. Ввиду распространенности стафилококковой инфекции у собак MRSP способны значительно ухудшить возможности эффективного лечения распространенных инфекций кожи и мягких тканей у животных. Фенотипическая вариабельность группы S. intermedins и необходимость точной дифференциации между MRSP и MRSA представляет собой сложную задачу для ветеринарных диагностических лабораторий, для решения которой может потребоваться пересмотр и обновление повседневных лабораторных методик. Ветеринарным клиникам следует внедрить меры строгого контроля инфекций, рекомендуемые при обнаружении MRSA, для предотвращения дальнейшего распространения MRSP, играющего большую роль патогена для животных и являющегося потенциально зооантропонозным микроорганизмом и новым резервуаром генов устойчивости. Возникновение MRSP подчеркивает важность благоразумного использования антибиотиков в ветеринарной практике.
Текст научной работы на тему «Что произошло со Staphylococcus intermedius? Пересмотр таксономической классификации и развитие лекарственной полирезистентности».
Авторы: R. Bond, A. Loeffler
Статья с сайта cyberleninka.ru